Un electrón ligado a un átomo gira sobre sí mismo, pero no podemos calcular su momento angular de rotación del mismo modo que calculamos el de la Tierra.
La idea de que el electrón tiene un movimiento de rotación fue propuesta en 1926 por G. Uhlenbeck y S. Goudsmit para explicar las características de los espectros de átomos con un solo electrón. La existencia del espín (rotación) del electrón está confirmada por muchos resultados experimentales, y se manifiesta de forma muy directa en el experimento de Stern-Gerlach, realizado en 1924.
En la simulación de este experimento, se comprobará la existencia del espín del electrón observando que un haz de átomos se divide en dos trazas simétricas al eje X. A partir de la medida de la desviación del haz, determinaremos el valor del magnetón de Bohr.
La simulación es similar al experimento de Thomson que realizamos para determinar la naturaleza de los denominados rayos catódicos y medir la razón entre la carga y la masa del electrón.
Se postula la existencia de un momento angular intrínseco del electrón
llamado espín S. Como el electrón es una partícula cargada, el espín del electrón debe
dar lugar a un momento magnético µ, intrínseco o de espín. La relación que existente entre el vector momento
magnético y el espín es
Donde g se denomina razón giromagnética del electrón, su valor experimental es
aproximadamente 2.
|
|
El
número de orientaciones del vector momento angular respecto a un eje Z fijo
es 2S+1, tenemos para el caso del espín S=1/2 que la
componente Z tiene dos valores permitidos
. Por lo que
mB se
denomina magnetón de Bohr.
|
Sabiendo que carga del electrón e=1.6·10-19 C, la masa m=9.1·10-31 kg y la constante de Planck h=6.63·10-34/(2p) Js. Obtenemos mB =9.27 10-24 Am2.
La energía
de un dipolo magnético µ en un campo magnético B que tiene la dirección del eje Z es el producto escalar
U=-µ·B=-µz·B=±µB·B
Si B es variable en la dirección Z, el dipolo magnético experimenta una
fuerza
|
|
que lo
desviará de su trayectoria rectilínea. Si el dipolo magnético es paralelo al
campo magnético, tiende a moverse en la dirección en la que el campo
magnético aumenta, mientras que si el dipolo magnético es antiparalelo al
campo magnético se moverá en la dirección en la que el campo magnético
disminuye.
|
En el experimento se usa un haz de átomos hidrogenoides, como plata,
litio, sodio, potasio y otros que constan de capas electrónicas completas salvo
la última en la que tienen un electrón. El momento angular orbital l de dicho electrón es cero, por lo que está en el estado s.
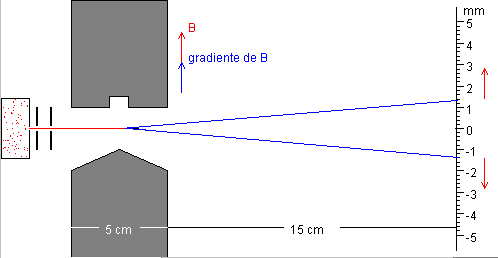
Se selecciona un haz de átomos de una velocidad dada y se le hace
atravesar una región en la que existe un campo magnético no homogéneo, tal como
se muestra en la figura.
1. Movimiento del átomo en la región en la que se ha establecido un
gradiente de campo magnético
Suponiendo que el gradiente de campo magnético es constante, la aceleración a lo largo del eje Z es constante, a lo largo del eje X es cero. Tenemos un movimiento curvilíneo bajo aceleración constante.
Suponiendo que el gradiente de campo magnético es constante, la aceleración a lo largo del eje Z es constante, a lo largo del eje X es cero. Tenemos un movimiento curvilíneo bajo aceleración constante.
Si la región en la que hay un gradiente de campo magnético tiene una
anchura L, la desviación que experimenta el haz, véase la figura, vale
1. Movimiento del átomo fuera de dicha región
Cuando el átomo de masa m abandona la región en la que hay un gradiente de campo magnético, sigue una trayectoria rectilínea con velocidad igual a la que tenía al abandonar la citada región. Las componentes de la velocidad serán
Cuando el átomo de masa m abandona la región en la que hay un gradiente de campo magnético, sigue una trayectoria rectilínea con velocidad igual a la que tenía al abandonar la citada región. Las componentes de la velocidad serán
La desviación total en la pantalla será
Midiendo d despejamos en dicha ecuación el valor mB del magnetón de Bohr.
2B. Experimento de
Stern-Gerlach
Se calienta una
sustancia paramagnética en un horno que emite un haz de átomos hidrogenoides
eléctricamente neutros con la misma velocidad v,
que siguen una trayectoria rectilínea hasta que se encuentran en una región en
la que hay un gradiente de campo magnético. Sobre la placa de observación
colocada perpendicularmente al haz observamos dos trazas finas del haz. Estas
trazas son simétricas respecto de la dirección incidente, tal como se ve en la
figura.Los resultados del experimento indican que el hecho de que se obtenga dos trazas distintas y simétricas prueba que el momento magnético no puede tomar más que dos orientaciones con respecto al campo magnético B. El momento magnético m del átomo es igual en módulo al magnetón de Bohr mB.
La simulación que se describe en esta página complementa la experiencia de Stern-Gerlach y comprueba que el momento magnético medio de los átomos depositados en la placa es inversamente proporcional a la temperatura absoluta (ley de Curie).
La energía de un átomo de momento magnético m en el campo magnético B viene dado por el producto escalar
E=-m·B
- Para
los átomos cuyo momento m
es paralelo a B vale E1=-μBB
- Para
los átomos cuyo momento m es antiparalelo a B vale E2=+μBB
Los átomos pueden estar en uno u otro de los dos niveles de energía E1 y E2. Aplicando la fórmula de la distribución
de Boltzmann podemos calcular la proporción de átomos que ocupan cada uno de los dos
niveles de energía
Naturalmente, n2=1-n1
n1 es mayor que n2, ya que la exponencial decreciente en el denominador no puede ser mayor
que la unidad, ni menor que cero. Por tanto, hay más átomos con el momento paralelo
al campo magnético que con el momento magnético apuntando en sentido contrario
al campo. La sustancia presenta un momento magnético no nulo.
<m>=n1 mB+n2(-mB)
Como  es mucho menor que la unidad (por
ejemplo, si B=1 T y la temperatura T=300 K el cociente vale 0.0045. Téngase en cuenta que mB=9.3 10-24 A m2, y k=1.38 10-23 J/K), utilizando el desarrollo en serie ex=1+x+... se obtiene
es mucho menor que la unidad (por
ejemplo, si B=1 T y la temperatura T=300 K el cociente vale 0.0045. Téngase en cuenta que mB=9.3 10-24 A m2, y k=1.38 10-23 J/K), utilizando el desarrollo en serie ex=1+x+... se obtiene
 es mucho menor que la unidad (por
ejemplo, si B=1 T y la temperatura T=300 K el cociente vale 0.0045. Téngase en cuenta que mB=9.3 10-24 A m2, y k=1.38 10-23 J/K), utilizando el desarrollo en serie ex=1+x+... se obtiene
es mucho menor que la unidad (por
ejemplo, si B=1 T y la temperatura T=300 K el cociente vale 0.0045. Téngase en cuenta que mB=9.3 10-24 A m2, y k=1.38 10-23 J/K), utilizando el desarrollo en serie ex=1+x+... se obtiene
El momento magnético medio es inversamente proporcional a la temperatura
absoluta de la sustancia, el comportamiento de los materiales paramagnéticos.
2C. Tabla
de partículas
Leptones
Leptones
cargados
|
||||||||
Nombre
|
Símbolo
|
Carga
|
Masa en
reposo (MeV)
|
Nombre
|
Símbolo
|
Carga
|
Masa en reposo
(MeV)
|
|
1ª generación
|
−1
|
0,511
|
0
|
< 3·10−6
|
||||
+1
|
0
|
|||||||
2ª generación
|
−1
|
105,658
|
0
|
< 0,19
|
||||
+1
|
0
|
|||||||
3ª generación
|
−1
|
1776,99
|
0
|
< 18,2
|
||||
+1
|
0
|
|||||||
Bosones
Nombre
|
Símbolo
|
Carga eléctrica
(e) |
Masa en reposo
(GeV/c²) |
Existencia
|
Vida media
|
Desintegraciones
más importantes
|
||
|
|
Neutra
|
Neutra
|
1
|
Nula
|
Confirmada
|
Estable
|
---
|
|
|
|
± 1
|
Neutra
|
1
|
80,425
|
Confirmada
|
3·10-25
|
|
|
|
|
Neutra
|
Neutra
|
1
|
91,187
|
Confirmada
|
3·10-25
|
---
|
|
g
|
Neutra
|
Color +
Anticolor
|
1
|
Nula
|
Confirmada
|
Estable
|
---
|
|
G
|
Neutra
|
Neutra
|
2
|
Nula
|
Hipotética
|
Estable
|
---
|
|
H
|
Neutra
|
Neutra
|
0
|
≈ 125.5
|
Confirmada
|
Inestable
|
|
Hidrogeno
Cuando se examinan las líneas del espectro
del hidrógeno a una resolución
muy alta, se encuentran que son dobletes poco espaciados entre sí. Esta
división se llama estructura fina y fue una de las primeras evidencias
experimentales del espín
electrónico.
|
|
Las pequeñas divisiones de la línea
espectral, se atribuye a una interacción entre el espín del electrón S, y el
momento angular orbital L. Se le llamainteracción
spin-órbita.
|
|
|
De acuerdo con la teoría
de Bohr, la conocida línea roja del
hidrógeno, H-alfa, es una sola línea. La aplicación directa de la ecuación de
Schrödinger al átomo de hidrógeno, da el mismo resultado. Si se calcula la
longitud de onda de esta línea, usando la expresión de energía de la teoría
de Bohr, se obtiene 656,11 nm para el hidrógeno, considerando el núcleo como
un centro fijo. Si se utiliza la masa
reducida, se obtiene 656,47
nm para el hidrógeno y 656,29 nm para el deuterio. La diferencia entre las
líneas del hidrógeno y el deuterio, es de aproximadamente 0,2 nm y la
división de cada una de ellas es de alrededor de 0,016 nm, correspondiente a
una diferencia de energía de alrededor de unos 0,000045 eV. Esto corresponde
a un campo magnético interno sobre el electrón, de aproximadamente 0,4 Tesla
|
Existen dos tipos distintos de moléculas diatómicas de
hidrógeno que difieren en la relación entre los espines de sus núcleos:
·
Orto - hidrógeno: los
espines de los dos protones se encuentran paralelos y conforman un estado
triplete.
·
Para - hidrógeno: los
espines de los dos protones se encuentran antiparalelos y conforman un estado
singlete.
En
condiciones normales de presión y temperatura el hidrógeno gaseoso contiene
aproximadamente un 25% de la formapara y
un 75% de la forma orto,
también conocida como "forma normal". La relación del equilibrio entre orto - hidrógeno y para - hidrógeno depende de la
temperatura, pero puesto que la forma orto es un estado excitado, y por tanto
posee una energía superior, es inestable y no puede ser purificada. A
temperaturas muy bajas, el estado de equilibrio está compuesto casi
exclusivamente por la forma para.
Las propiedades físicas del para - hidrógeno puro difieren ligeramente de las
de la forma normal (orto). La
distinción entre formas orto / para también se presenta en otras moléculas
o grupos funcionales que contienen hidrógeno, tales como el agua o el metileno.
La
interconversión no catalizada entre el para - hidrógeno y el orto - hidrógeno
se incrementa al aumentar la temperatura; por esta razón, el H2 condensado rápidamente contiene
grandes cantidades de la forma orto que pasa a la forma paralentamente.14 La relación orto / para en el H2 condensado es algo importante a tener
en cuenta para la preparación y el almacenamiento del hidrógeno líquido: la
conversión de la forma orto a la forma para es exotérmica y
produce el calor suficiente para evaporar el hidrógeno líquido, provocando la
pérdida del material licuado. Catalizadores para la interconversión orto / para,
tales como compuestos de hierro, son usados en
procesos de refrigeración con hidrógeno.
2D. RESONANCIA MAGNETICA NUCLEAR
Es un fenómeno físico basado en las propiedades mecánico-cuánticas de los núcleos atómicos. RMN también se refiere a la familia de métodos científicos que explotan este fenómeno para estudiar moléculas (espectroscopia de RMN), macromoléculas (RMN biomolecular), así como tejidos y organismos completos (imagen por resonancia magnética).
Todos los núcleos que poseen un número impar de protones o neutrones tienen un momento magnético y un momento angular intrínseco, en otras palabras, tienen un espín > 0. Los núcleos más comúnmente empleados en RMN son el protón (1H, el isótopo más sensible en RMN después del inestable tritio, 3H), el 13C y el 15N, aunque los isótopos de núcleos de muchos otros elementos (2H, 10B, 11B, 14N, 17O, 19F, 23Na, 29Si, 31P, 35Cl, 113Cd, 195Pt) son también utilizados.
Las frecuencias a las cuales resuena un núcleo atómico (i. e. dentro de una molécula) son directamente proporcionales a la fuerza del campo magnético ejercido, de acuerdo con la ecuación de la frecuencia de precesión de Larmor. La literatura científica hasta el 2008 incluye espectros en un gran intervalo de campos magnéticos, desde 100 nT hasta 20 T). Los campos magnéticos mayores son a menudo preferidos puesto que correlacionan con un incremento en la sensibilidad de la señal. Existen muchos otros métodos para incrementar la señal observada. El incremento del campo magnético también se traduce en una mayor resolución espectral, cuyos detalles son descritos por el desplazamiento químico y el efecto Zeeman.
La RMN estudia los núcleos atómicos al alinearlos a un campo magnético constante para posteriormente perturbar este alineamiento con el uso de un campo magnético alterno, de orientación ortogonal. La resultante de esta perturbación es el fenómeno que explotan las distintas técnicas de RMN. El fenómeno de la RMN también se utiliza en la RMN de campo bajo, la RMN de campo terrestre y algunos tipos de magnetómetros.
2D. RESONANCIA MAGNETICA NUCLEAR
Es un fenómeno físico basado en las propiedades mecánico-cuánticas de los núcleos atómicos. RMN también se refiere a la familia de métodos científicos que explotan este fenómeno para estudiar moléculas (espectroscopia de RMN), macromoléculas (RMN biomolecular), así como tejidos y organismos completos (imagen por resonancia magnética).
Todos los núcleos que poseen un número impar de protones o neutrones tienen un momento magnético y un momento angular intrínseco, en otras palabras, tienen un espín > 0. Los núcleos más comúnmente empleados en RMN son el protón (1H, el isótopo más sensible en RMN después del inestable tritio, 3H), el 13C y el 15N, aunque los isótopos de núcleos de muchos otros elementos (2H, 10B, 11B, 14N, 17O, 19F, 23Na, 29Si, 31P, 35Cl, 113Cd, 195Pt) son también utilizados.
Las frecuencias a las cuales resuena un núcleo atómico (i. e. dentro de una molécula) son directamente proporcionales a la fuerza del campo magnético ejercido, de acuerdo con la ecuación de la frecuencia de precesión de Larmor. La literatura científica hasta el 2008 incluye espectros en un gran intervalo de campos magnéticos, desde 100 nT hasta 20 T). Los campos magnéticos mayores son a menudo preferidos puesto que correlacionan con un incremento en la sensibilidad de la señal. Existen muchos otros métodos para incrementar la señal observada. El incremento del campo magnético también se traduce en una mayor resolución espectral, cuyos detalles son descritos por el desplazamiento químico y el efecto Zeeman.
La RMN estudia los núcleos atómicos al alinearlos a un campo magnético constante para posteriormente perturbar este alineamiento con el uso de un campo magnético alterno, de orientación ortogonal. La resultante de esta perturbación es el fenómeno que explotan las distintas técnicas de RMN. El fenómeno de la RMN también se utiliza en la RMN de campo bajo, la RMN de campo terrestre y algunos tipos de magnetómetros.





























No hay comentarios:
Publicar un comentario